|
||||
|
|
15. Общие свойства неметаллов Исходя из положения неметаллов в периодической системе Менделеева, можно выявить свойства для них характерные. Можно определить количество электронов на внешнем энергетическом подуровне, местоположение неметаллов в конце малых и больших периодов, число электронов на внешнем подуровне соответствует номеру группы. В периоде идет возрастание способности присоединять электроны, а в группе это свойство можно наблюдать по мере уменьшения радиуса (в периоде снизу вверх). Для неметаллов характерно свойство присоединять электроны, проявлять окислительные свойства. Наиболее они выражены у элементов VI и VII групп. Самый сильный окислитель – фтор. Окислительные свойства неметаллов возрастают в последовательности: 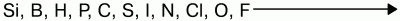 Фтор никогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов. Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду: 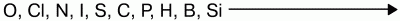 Так, хлор напрямую не взаимодействует с кислородом, но можно получить оксиды хлора (Cl2O, ClO2, Cl2O7), в которых хлор проявляет положительную степень окисления. Азот при высоких температурах вступает в реакцию с кислородом, выказывая восстановительные свойства: 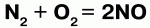 Сера проявляет как окислительные, так и восстановительные свойства: S + O2 = SO2 – окислительные свойства серы; S + H2 = H2S – восстановительные свойства серы. В нормальных условиях неметаллы: 1) газы (водород, фтор, хлор, кислород, азот и благородные газы); 2) жидкость (бром); 3) твердые вещества (все остальные). Из-за разницы строения кристаллической решетки свойства неметаллов отличаются друг от друга. C, B, Si – немолекулярное строение – атомная кристаллическая решетка. F2, O2, Cl2, Br2, N2, I2, S8, P4 – молекулярное строение – молекулярная кристаллическая решетка. С водородом образуют летучие соединения – газы и жидкости. С кислородом образуют кислотные оксиды. Атомы инертных газов содержат на внешнем уровне по 8 электронов (у гелия – 2). До середины XX века считалось, что такие атомы не способны ни отдавать электроны, ни принимать их, ни образовывать общие электронные пары. В 1962 г. был получен тетрафторид ксенона XeF4, первое химическое соединение инертного газа. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
