|
||||
|
|
26. Сероводород и сульфиды Сероводород (H2S) – бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных. Получение: 1) прямой синтез из элементов, при температуре 600 °C; 2) воздействием на сульфиды натрия и железа соляной кислотой. Физические свойства: сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота. Химические свойства: сероводород – сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты: 1) горит голубоватым пламенем на воздухе:  2) при высокой температуре разлагается: 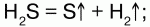 3) вступает в реакцию с галогенами: 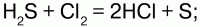 4) взаимодействует с окислителями:  5) серебро при взаимодействии с сероводородом темнеет: 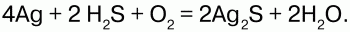 Применение: сероводород используют как химический реактив, а также как сырье для получения серы и серной кислоты. Сероводородная кислота – слабая кислота. Водный раствор сероводорода. Сульфиды – средние соли сероводородной кислоты. Получение сульфидов: 1) взаимодействие металлов с серой при высокой температуре: Fe + S = FeS; 2) взаимодействие сводными растворами солей металлов: CuSO4 + H2S = CuS? + H2SO4; 3) сульфиды подвергаются гидролизу: 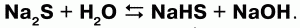 Взбалтывая раствор сульфида с серой можно обнаружить после выпаривания остаток, содержащий полисульфиды (многосернистые металлы). Полисульфиды – соединения с большим содержанием серы, например Na2S2, Na2S5. Для сульфидов характерны соединения переменного состава (FeS1,01—FeS1,14). Природные сульфиды – основа руд цветных и редких металлов, поэтому их используют в металлургии. Некоторые сульфиды используют в производстве серной кислоты(FeS2 – железный колчедан). В химической и легкой промышленности применяют сульфиды щелочных и щелочноземельных металлов (в качестве основы люминофоров). В электронной технике используются как полупроводники. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
