|
||||
|
|
31. Соли аммония Соли аммония – сложные вещества, включающие катионы аммония NH4+и кислотные остатки. Физические свойства: соли аммония – твердые кристаллические вещества, хорошо растворимые в воде. Химические свойства: аммоний обладает свойствами металла, поэтому строение его солей подобно солям щелочных металлов, т. к. ионы NH4+и ионы щелочных металлов (калия) имеют примерно одинаковые радиусы. В свободном виде аммоний не существует, т. к. он химически нестоек и мгновенно разлагается на аммиак и водород. Доказательством металлического характера аммония является наличие амальгамы аммония – сплав аммония с ртутью, схожего с таковой щелочных металлов. При обработке амальгамы аммония холодным раствором сульфата меди, амальгама вытеснит n-е количество меди: 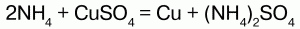 Соли аммония имеют ионную решетку и обладают всеми свойствами типичных солей: 1) являются сильными электролитами – подвергаются диссоциации в водных растворах, образуя катион аммония и анион кислоты:  2) подвергаются гидролизу (соль слабого основания и сильной кислоты): 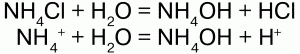 среда кислая, рН<7, лакмус красный; 3) вступают в обменную реакцию с кислотами и солями: 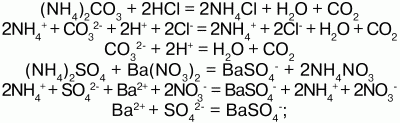 4) взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония: 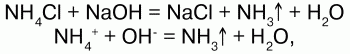 соли аммония определяют по запаху выделившегося в результате реакции аммиака, а также по синей окраске лакмуса; 5) разлагаются при нагревании: 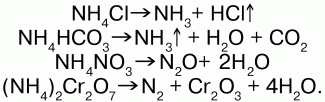 Получение: NH3 + HNO3 = NH4NO3 (нитрат аммония); 2NH4OH + H2SO4 = (NH4)2SO4 (cульфат аммония) + 2Н2O. Применение: соли аммония широко применяются на практике: сульфат аммония – (NH4)2SO4, нитрат аммония – NH4NO3, дигидрофосфат аммония – NH4Н2РO4 и гидрофосфат аммония – (NH4)2НРO4 используются в качестве минерального удобрения. Преимущество удобрения – повышенное содержание в нем аммиака. Используется хлорид аммония (NH4Cl) – нашатырь. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
