|
||||
|
|
32. Оксиды азота С кислородом N образует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3. Оксид азота I – N2O – закись азота, «веселящий газ». Физические свойства: бесцветный, со сладковатым запахом, растворим в воде, t плавления -91 °C, t кипения -88,5 °C. Анестезирующее средство. Химические свойства: разлагается при 700 °C: 2N2O?2N2 + O2 поддерживает горение и является окислителем; взаимодействует с водородом: N2+1O + H2?N20+ Н2O. Получение: NH4NO3?N2O + 2Н2O. N2O соответствует азотноватистая кислота: Н2N2O2, но при действии Н2O и щелочей он не образует ни Н2N2O2, ни ее солей. N2O – несолеобразующий. Оксид азота (II) NO – окись азота. Физические свойства: бесцветный газ, плохо растворим в воде, t плавления -164 °C, t кипения -152 °C. Химические свойства: NO обладает окислительно-восстановительными свойствами: 1) при обычной температуре устойчив, при понижении t димеризуется в N2O2; 2) при 700 °C разлагается: 2NO?2N2 + O2? поддерживая горение, является восстановителем; 3) с водородом. Смесь равных объемов NO и H2 взрывается: 2NO + 2H2 = N2? + Н2O, где NO – окислитель; 4) с галогенами: 2NO + Сl2 = 2NOСl? (нитрозилхлорид). NO – несолеобразующий. Получение: 1) в лаборатории: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O; 2) в промышленности: каталитическое окисление аммиака: 4NH3 +5O2 = 4NO? + 6H2O; 3) NO образуется в грозу: N2 + O2 = 2NO?. Оксид азота (III) N203. Физические свойства: темно-синяя жидкость (при низких t), t плавления -102 °C, t кипения 3,5 °C. Химические свойства: N2O3 – ангидрид азотистой кислоты HN02. При взаимодействии с водой и щелочами соответственно дает НNO2 и ее соли – нитриты: N2O + 2NaOH = 2NaNO2 + H2O. Получение: NO2 + NO = N2O3. Оксид азота (IV) – NO2. Физические свойства: ядовитый газ бурого цвета с резким запахом; t плавления —11,2 °C, t кипения – 21 °C. Химические свойства: кислотный ангидрид: 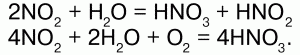 Реагирует со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O. Окислитель: N+4O2 + S+4O2 = S+6O3 + N+2O. Димеризуется при низких температурах: 2NO2(бурый газ)?N2O4(бесцветная жидкость). Получение: 2NO + O2 = 2NO2; Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O. Оксид азота (V) – N2O5. Физические свойства: малостойкое белое кристаллическое вещество. Сильный окислитель. Химические свойства: ангидрид HN03. 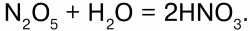 Разлагается со взрывом: 2N2O5?4NO2 + О2. Получение: 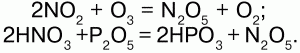 |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
