|
||||
|
|
40. Оксиды углерода. угольная кислота Углерод с кислородом образует оксиды: СО, СО2, С3О2, С5О2, С6О9 и др. Оксид углерода (II) – СО. Физические свойства: угарный газ, без цвета и запаха, ядовит, в воде почти не растворим, растворим в органических растворителях, t кипения = -192 °C, t плавления = -205 °C. Химические свойства: несолеобразующий оксид. В обычных условиях малоактивен, при нагревании проявляет восстановительные свойства: 1) с кислородом: 2C+2O + O2 = 2C+4O2; 2) восстанавливает металлы из руд: C+2O + CuO = Сu + C+4O2; 3) с хлором (на свету): CO + Cl2 = COCl2(фосген); 4) с водородом: СО + Н2 = СН3ОН (метанол); 5) с серой: СО + S = СОS (сульфоксид углерода); 6) реагирует с расплавами щелочей: CO + NaOH = HCOONa (формиат натрия); 7) с переходными металлами образует карбонилы: Ni + 4CO = Ni(CO)4, Fe + 5CO = Fe(CO)5. СО легко соединяется с гемоглобином – Hb крови, образуя карбоксигемоглобин, препятствуя переносу О2 от легких к тканям: Hb + CO = HbCO. При вдохе воздуха карбогемоглобин распадается на исходные продукты: HbCO?Hb + CO. Получение: 1) в лаборатории – термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.): 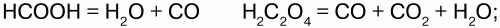 2) в промышленности (в газогенераторах):  Оксид углерода (IV) СO2. Физические свойства: углекислый газ, без цвета и запаха, малорастворим в воде, тяжелее воздуха, t плавления = -78,5 °C, твердый CO2 – сухой лед, не поддерживает горение. Получение: 1) в промышленности (обжиг известняка): CaCO3?CaO + CO2; 2) действием сильных кислот на карбонаты и гидрокарбонаты: CaCO3(мрамор) + 2HCl =CaCl2 + H2O + CO2; NaHCO3 + HCl = NaCl + H2O + CO2. Химические свойства: кислотный оксид, реагирует с основными оксидами и основаниями, образуя соли угольной кислоты: 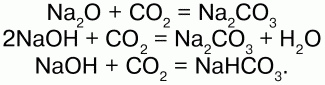 При повышенной температуре проявляет окислительные свойства: С+4O2 + 2Mg = 2Mg+2O + C0. Качественная реакция – помутнение известковой воды: Ca(OH)2 + CO2 = CaCO3(белый осадок) + H2O. Угольная кислота – слабая, существует в водном растворе: CO2 + H2O = H2CO3. Соли: средние – карбонаты (СО32-), кислые – бикарбонаты, гидрокарбонаты (НС03-). Карбонаты и гидрокарбонаты превращаются друг в друга: 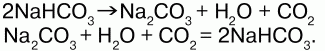 Качественная реакция – «вскипание» при действии сильной кислоты: Na2CO3 + 2HCl = 2NaCl + H2O + CO2; CO32-+ 2H+= H2O + CO2. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
