|
||||
|
|
52. Натрий и калий Натрий и калий – щелочные металлы, стоят в 1 группе главной подгруппы. Физические свойства: схожи по физическим свойствам: легкие серебристо-белые мягкие металлы, с невысокими температурами плавления и кипения, малой плотностью. Пары натрия имеют желтый цвет, а пары калия – фиолетовый. Природный натрий состоит из одного изотопа (23), а К – из двух изотопов (39) и (41). Химические свойства: химические свойства натрия и калия очень схожи, калий активнее натрия, так как радиус его атома больше и внешний 1s-электрон находится дальше от ядра. Электронная конфигурация Na: 1s22s1; К: 1s22s12р63s1. Они легко отдают один электрон, имеющийся на внешнем s-подуровне, превращаясь в положительно заряженные ионы. На воздухе тускнеют и окисляются. Связь между атомами металлическая. Соединения с натрием и калием носят ионный характер. Высокая химическая активность. 1. Очень бурно реагируют с кислородом: 2Na + О2 = Na2O2 (пероксид натрия) при t ниже180 °C: 4Na + О2 = 2Na2O. Аналогичные реакции идут с калием, но калий образует еще и надпероксид – KO2. 2. С водой идет бурная реакция: 2Na + 2H2O = 2NaOH + H2?. У калия данная реакция проходит с воспламенением водорода: 2К + 2H2O = 2KOH + H2?. 3. Реагируют с водородом при нагревании, образуя солеобразные гидриды: 2Na + H2 = 2NaH. 4. Легко взаимодействуют с серой, образуя сульфиды: 2Na + S = Na2S. 5. В атмосфере фтора и хлора натрий и калий воспламеняются, сгорают и образуют соли: 2Na + Cl2 = 2NaCl. 6. С жидким бромом натрий пассивно взаимодействует: 2Na + Вr2 = 2NaВr, а калий реагирует со взрывом: 2К + Вr2 = 2КВr. 7. При пропускании над расплавленным натрием и калием газообразного аммиака образуются амиды: 2Na + 2NН3 = 2NaNН2 + Н2?; 2К + 2NН3 = 2КNН2 + Н2?. 8. Реагируют с водосодержащими соединениями – со спиртами, образуя алкоголяты: 2К + С2Н5ОН = 2С2Н5ОК (этилат калия) + Н2?. Со ртутью калий и натрий образуют амальгамы – твердые сплавы – восстановители вместо чистых металлов. Получение натрия и калия: 1) восстановлением из их оксидов: Si + 2К2O = SiO2 + 4К; 2) электролизом расплава гидроксидов: 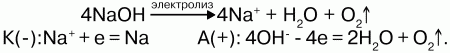 Нахождение в природе: Na и К встречаются в виде солей в морской воде, а также в виде поваренной соли. Наибольшее значение имеют минералы сильвинит – КCl?NaCl и карналлит – КCl?МgCl2?6Н2О. Натрий и калий – одни из самых распространенных элементов в земной коре. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
