|
||||
|
|
57. Оксид и гидроксид кальция Оксид кальция (СаO) – негашеная или жженая известь – белое огнестойкое вещество, образованное кристаллами. Кристаллизуется в кубической гранецентрированной кристаллической решетке. Температура плавления – 2627 °C, температура кипения – 2850 °C. Называется жженой известью из-за способа его получения – обжигание карбоната кальция. Обжиг производят в высоких шахтных печах. В печь закладывают слоями известняк и топливо, а затем разжигают снизу. При накаливании происходит разложение карбоната кальция с образованием оксида кальция: 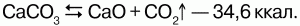 Так как концентрации веществ в твердых фазах неизменны, то константу равновесия этого уравнения можно выразить так: K = [CO2]. При этом концентрация газа может быть выражена с помощью его парциального давления, то есть равновесие в системе устанавливается при определенном давлении диоксида углерода. Давление диссоциации вещества – равновесное парциальное давление газа, получающееся при диссоциации вещества. Чтобы спровоцировать образование новой порции кальция, необходимо повысить температуру или удалить часть получившегося CO2, при этом уменьшится парциальное давление. Поддерживая постоянное более низкое парциальное давление, чем давление диссоциации, можно добиться непрерывного процесса получения кальция. Для этого при обжигании извести в печах делают хорошую вентиляцию. Получение: 1) при взаимодействии простых веществ: 2Ca + O2 = 2CaO; 2) при термическом разложении гидроксида и солей: 2Ca(NO3)2 = 2CaO + 4NO2? + O2?. Химические свойства: 1) взаимодействует с водой: СаO + H2O = Са(OH)2; 2) реагирует с оксидами неметаллов: СаO + SO2 = CaSO3; 3) растворяется в кислотах, образуя соли: CaO + 2HCl = CaCl2 +H2O. Гидроксид кальция (Ca(OH)2 – гашеная известь, пушонка) – белое кристаллическое вещество, кристаллизуется в гексагональной кристаллической решетке. Является сильным основанием, плохо растворимым вводе. Известковая вода – насыщенный раствор гидроксида кальция, имеющий щелочную реакцию. На воздухе мутнеет в результате поглощения углекислого газа, образуя карбонат кальция. Получение: 1) образуется при растворении кальция и оксида кальция вводе: CaO + H2O = Са(OH)2 + 16 ккал; 2) при взаимодействии солей кальция со щелочами: Ca(NO3)2 + 2NaOH = Ca(OH)2 + 2NaNO3. Химические свойства: 1) при нагревании до 580 °C разлагается: Са(OH)2 = СаO + H2O; 2) реагирует с кислотами: Ca(OH)2 + 2HCl = CaCl2 + 2H2O. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
