|
||||
|
|
68. Соединения железа Оксид железа (II) FeO – черное кристаллическое вещество, нерастворимое в воде и щелочах. FeO соответствует основание Fe(OH)2. Получение. Оксид железа (II) можно получить неполным восстановлением магнитного железняка оксидом углерода (II): 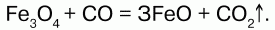 Химические свойства. Является основным оксидом. Реагируя с кислотами, образует соли: 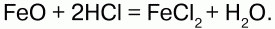 Гидроксид железа (II) Fe(OH)2 – кристаллическое вещество белого цвета. Получение. Гидроксид железа (II) получается из солей двухвалентного железапри действии растворов щелочей: 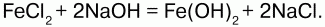 Химические свойства. Основный гидроксид. Вступает в реакции с кислотами: 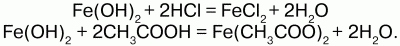 На воздухе Fe(OH)2 окисляется до Fе(ОН)3: 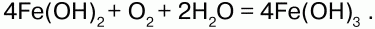 Оксид железа(III) Fe2O3 – вещество бурого цвета, встречается в природе в виде красного железняка, нерастворим в воде. Получение. При обжиге пирита: 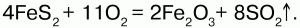 Химические свойства. Проявляет слабые амфотерные свойства. При взаимодействии со щелочами образует соли: 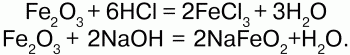 Гидроксид железа (III) Fe(OH)3 – вещество красно-бурого цвета, нерастворимое в воде и избытке щелочи. Получение. Получают путем окисления оксида железа (III) и гидроксида железа (II). Химические свойства. Является амфотерным соединением (с преобладанием основных свойств). Выпадает в осадок при действии щелочей на соли трехвалентного железа: 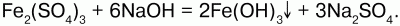 Соли двухвалентного железа получают взаимодействием металлического железа с соответствующими кислотами. Они сильно гидро-лизуются, потому их водные растворы – энергичные восстановители: 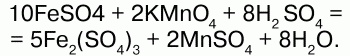 При нагревании выше 480 °C разлагается, образуя оксиды: 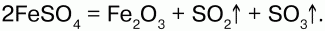 При действии щелочей на сульфат железа (II) образуется гидроксид железа (II): 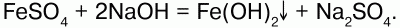 Образует кристаллогидрат – FeSO4?7Н2О (железный купорос). Хлорид железа (III) FeCl3 – кристаллическое вещество темно-коричневого цвета. Химические свойства. Растворим в воде. FeCl3 проявляет окислительные свойства. Восстановители – магний, цинк, сероводород, окисляются без нагревания. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
